
艾克发学术 | Blood:IF=21,经典霍奇金淋巴瘤治疗新方法点燃R/R cHL治疗新希望!
2024-09-14
霍奇金淋巴瘤(HL)是一种影响淋巴结和淋巴系统的血液恶性肿瘤。在中国,HL占所有淋巴瘤的8.5%,经典型霍奇金淋巴瘤(cHL)占95%以上。虽然大多数cHL患者经过联合化疗和放疗后可实现临床治愈,但约20%的患者在一线治疗后复发,发展为复发/难治性经典型霍奇金淋巴瘤(R/R cHL)。
近年来,抗PD-1免疫治疗等新疗法改善了患者的生存率,但部分患者在治疗后仍会出现耐药或复发,构成临床挑战。因此,迫切需要新的治疗方法来提高患者生存率和生活质量。
2024年8月2日中国人民解放军总医院韩为东、聂晶研究团队在血液学顶刊Blood(IF=21)上发表题为“Epigenetic agents plus anti-PD-1 reshapes tumor microenvironment and restores antitumor efficacy in Hodgkin lymphoma”的研究论文[1]。该研究旨在评估CDP疗法(组蛋白去乙酰酶抑制剂西达本胺、DNA甲基转移酶抑制剂地西他滨和抗PD-1抗体卡瑞利珠单抗)在先前接受过DP疗法(地西他滨加卡瑞利珠单抗)后复发/进展的cHL患者中的安全性和有效性,这对于治疗方案的开发和改善DP治疗后复发患者的预后意义重大,同时通过肿瘤微环境解析指出 HRS 肿瘤异质性,阐释表观免疫治疗 cHL 抗瘤效能关键作用机理——靶向CD30- HRS样细胞治疗和阻断IL-21通路,这也为其他肿瘤免疫治疗奠定理论基础。

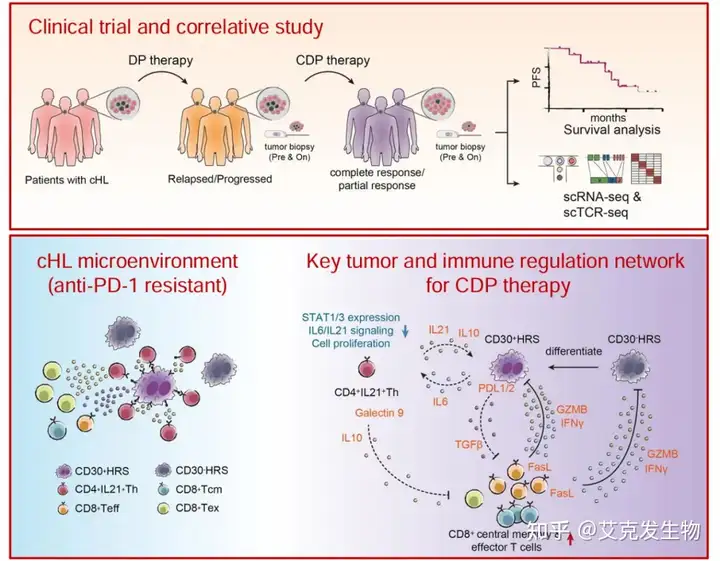
(研究概览)
1.患者情况
研究者入组了52名复发或进展的cHL患者接受三药联合CDP治疗。患者中位年龄为29岁,96%的患者接受过三次或以上的系统治疗,先前治疗的中位次数为5次。12名患者曾接受自体干细胞移植,40名患者因各种原因被认为不适合移植。85%的患者在研究前最后一次治疗为地西他滨加抗PD-1(DP),客观缓解率为77%,其中29%患者达到了完全缓解。先前DP治疗的中位无进展生存期为14.6个月。
2.CDP治疗的疗效
截至2023年12月10日,52名接受CDP(西达本胺-地西他滨-卡瑞利珠单抗)联合治疗的患者中,94%获得客观反应,50%达到了完全缓解(CR)。中位治疗周期为20次,持续时间21个月。对于至少接受5次前期治疗的患者,客观反应率为90%。在中位随访32个月后,12名持续CR的患者停用CDP治疗,且所有患者存活。中位无进展生存期(PFS)为29.4个月,1年和2年的PFS率分别为94%和60%。常见的不良事件包括白细胞减少(73.1%)和腹泻(36.5%),无患者因不良事件停止治疗。总体来看,CDP治疗显示出良好的疗效和安全性。
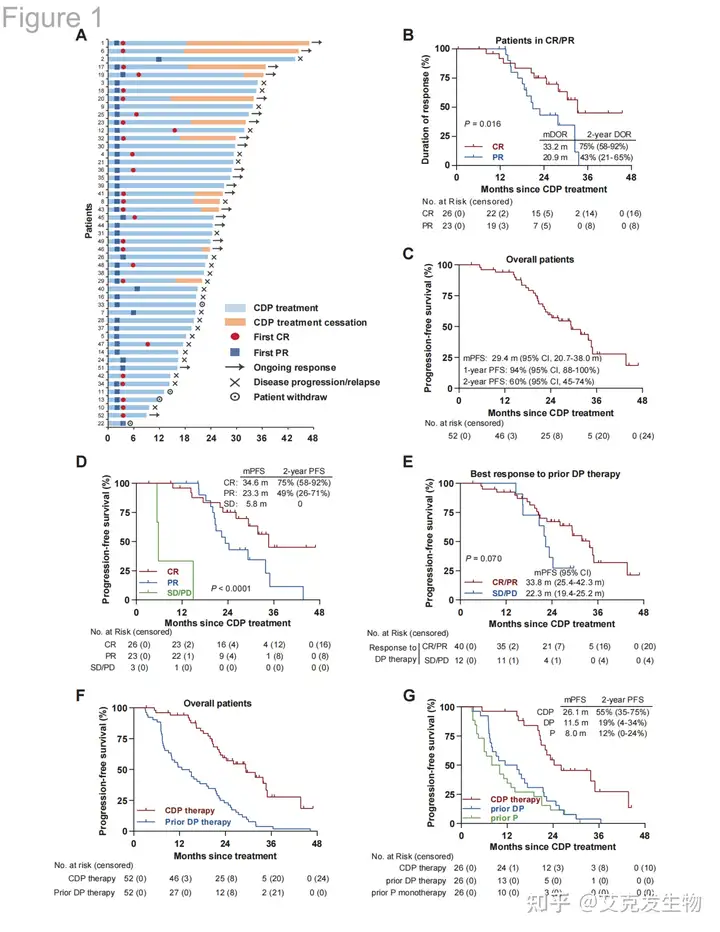
图1 无进展生存期(源自论文[1])
3.scRNA-seq详细表征HRS样细胞
研究者通过scRNA-seq对cHL中的Hodgkin Reed/Sternberg(HRS)样细胞进行了深入分析,建立了一个涵盖9名患者17个活检样本的单细胞图谱。同时,通过单细胞T细胞受体测序(scTCR-seq)识别出82684种克隆类型。经研究发现少部分细胞被标识为HRS样细胞,这些细胞表达CD30(TNFRSF8)及DHRS2等特征性标记物。值得注意的是,研究中还发现了一些CD30-HRS样细胞,这一发现挑战了CD30作为HRS细胞普遍表达标志的传统观点。在CD30+和CD30-HRS样细胞中,经典HRS标记物PAX5、IRF4和FUT4均表现出下调,而DHRS2基因则特异性高表达。研究表明两种HRS样细胞共享某些体细胞突变,暗示它们可能具有共同的克隆起源。主成分分析进一步揭示,这两类细胞在生物学状态上存在连续性,CD30-细胞表现出更高的分化潜力,但免疫通路的活性较低。最后研究者通过多重免疫组化(mIHC)验证了DHRS2+CD30-HRS样细胞的存在,为理解HRS样细胞的多样性和功能提供了新的视角。
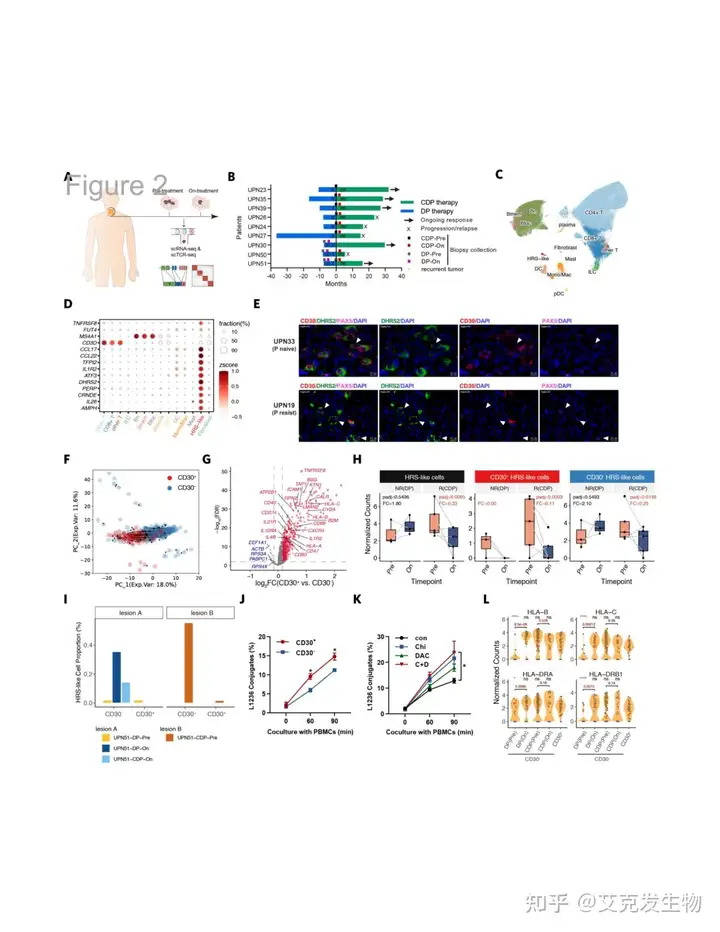
图2 cHL肿瘤微环境及HRS样细胞与治疗反应的关系(源自论文[1])
4.CD30-HRS样细胞对PD-1不敏感,对CDP治疗有响应
研究者通过五组对CDP疗法有响应的肿瘤和三组对DP疗法有抗性的肿瘤进行治疗相关分析,以探索逆转抗PD-1抗性的关键因素。研究结果表明响应CDP疗法的肿瘤中总HRS样细胞的数量显著减少,而对DP疗法无响应的肿瘤中未观察到减少。这一发现表明,CD30- HRS样细胞在CDP治疗后数量减少,提示它们可能对抗PD-1的免疫疗法敏感性较低,研究者通过进一步的患者案例验证了这一假设,在DP治疗失败后,有观察到CD30- HRS样细胞的转录表型转变为CD30+ HRS样细胞。研究者使用表观遗传药物如西达本胺和地西他滨处理L1236 HL细胞系,导致HLA基因表达增加,进一步增强了免疫识别能力,然而研究表明仅依靠HLA基因的上调可能不足以完全消除肿瘤,仍需其他免疫调节作用来增强抗肿瘤效果。总的来说,这些结果提示了CDP方案在DP治疗失败后的有效性可能与CD30-HRS样细胞的耗竭有关,同时强调了表观遗传药物在增强免疫识别中的潜力,但也指出了需要综合多种策略来提高疗效。

图3 表观遗传学药物-免疫治疗促进多种CD8+肿瘤反应性T细胞介导的抗肿瘤反应(源自论文[1])
5.表观免疫激活多种肿瘤反应性CD8+ T细胞介导的抗肿瘤反应
研究者观察到在经过CDP治疗后CD8+ T细胞显著增加,而NK细胞没有明显变化。通过对T/ILC细胞的重新聚类分析,识别出五个高表达PDCD1的CD8+T细胞簇,其中一个被标记为CD8+滤泡辅助T细胞(CD8+Tfh),其余四个则表现出耗竭表型但仍具细胞毒性。CDP治疗后,整体CD8+T细胞的克隆性显著增加,在对CDP治疗有反应的肿瘤中克隆数发生扩增的较多,减少的克隆中耗竭T细胞(Tex)占比较高,表明CDP治疗减轻了T细胞的耗竭现象。此外HAVCR2+Tex细胞显示出高细胞毒性和克隆性,可能具有肿瘤反应性。CDP治疗后,多个非耗竭细胞毒性簇与HAVCR2+Tex表现出高TCR共享,进一步支持CD8+T细胞向非耗竭效应状态转变的假设。CD8+T细胞簇与临床反应的关联分析显示,CDP治疗后高细胞毒性的簇显著增加,同时HAVCR2+Tex在治疗前已丰富,提示先前治疗激活了肿瘤反应性T细胞,但其他因素可能阻碍了有效的抗肿瘤免疫反应。
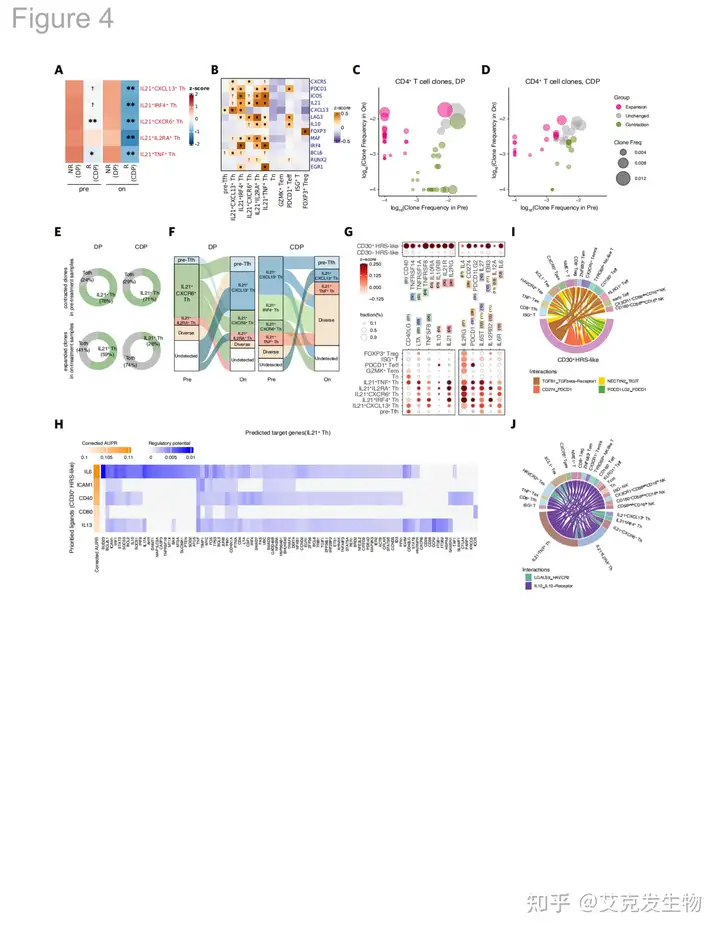
图4 表观遗传学药物-免疫治疗抑制肿瘤并且免疫抑制的IL21+ Th细胞(源自论文[1])
6.免疫抑制IL21+Th细胞与恶性HRS细胞相互作用
经过CDP治疗后,CD4+T细胞中的IL21+辅助T细胞(Th细胞)在响应者中显著减少,而在非响应者的肿瘤中的丰度在治疗前和治疗期间均较高。且这些细胞表现出高水平的IL21及CXCR5、PDCD1和ICOS,显示出类似滤泡辅助T细胞(Tfh)的表型,暗示其可能具有免疫抑制功能。分化轨迹表明IL21+ Th细胞与前Tfh细胞形成分支,IL21+Th细胞的扩增克隆在DP组中增加,而CDP组则抑制了这些细胞的扩增,促使其停留在靠前的分化状态。同时,CD30+ HRS样细胞与IL21+ Th细胞之间存在多种相互作用,包括细胞因子分泌和受体表达,可能通过IL6和CD40对IL21+Th细胞产生调节作用。IL21+Th细胞通过分泌IL10等配体也可能调节CD30+HRS细胞的生存,形成正反馈环路,促进肿瘤的生长和免疫逃逸,这一机制的发现为后续治疗策略提供了潜在靶点。
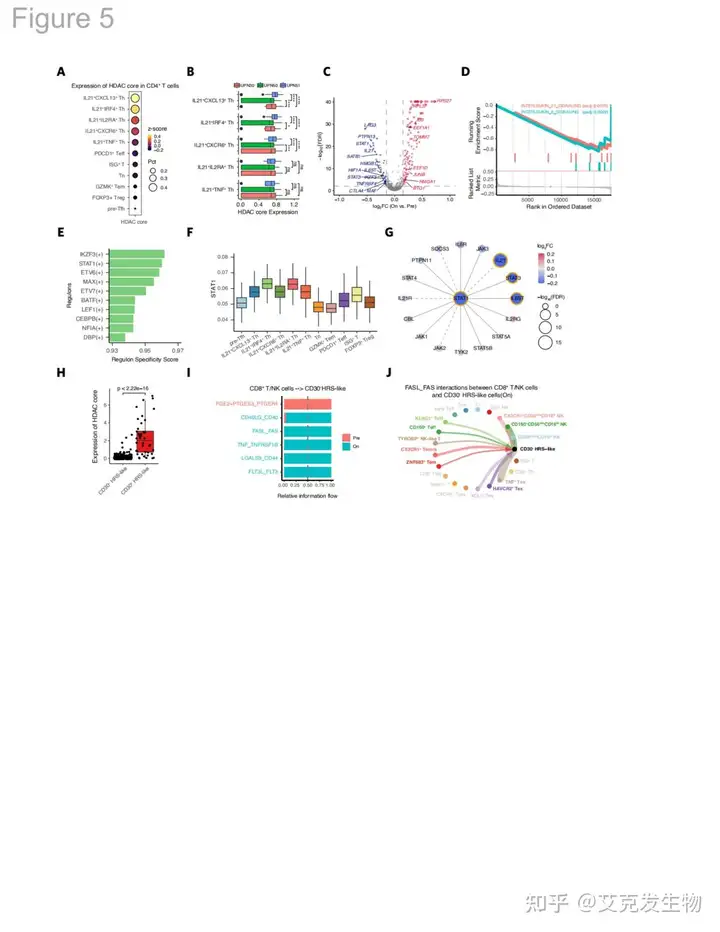
图5 CDP疗法重编程IL21+ Th细胞(源自论文[1])
7.表观免疫重新编程IL21+Th细胞
研究者为了进一步揭示CDP治疗的机制,重点分析了IL21+Th细胞和CD30- HRS样细胞的变化。结果表明CDP治疗后IL21+Th细胞的组蛋白去乙酰化酶(HDAC)评分显著高于非响应患者,表明IL21+Th细胞可能是CDP治疗的直接靶点。治疗后,IL21+Th细胞的基因表达和信号通路活性显著下降,特别是与IL21和IL6相关的信号通路,关键转录因子STAT1/3和IKZF3的表达也显著降低。此外,CD30-HRS样细胞的HDAC评分较低,表明CDP治疗对CD30-HRS样细胞可能有间接影响,CDP治疗增强了CD8+ T细胞/NK细胞与CD30-HRS细胞之间的相互作用,激活了细胞毒性反应。总体来看,CDP治疗通过改变IL21+ Th细胞的表型和功能,抑制了对CD30+HRS细胞的免疫支持,并提高了CD30-HRS细胞的免疫原性和细胞毒性反应,从而改善了cHL患者的免疫环境和治疗效果。
本文中涉及的mIHC实验(Panel:CD30、DHRS2、PAX5、DAPI)利用艾克发生物的AlphaXTSA®多靶点免疫组化染色试剂盒(CAT#AXT37100031)直观检测到了DHRS2+CD30-PAX5dim+细胞的存在。
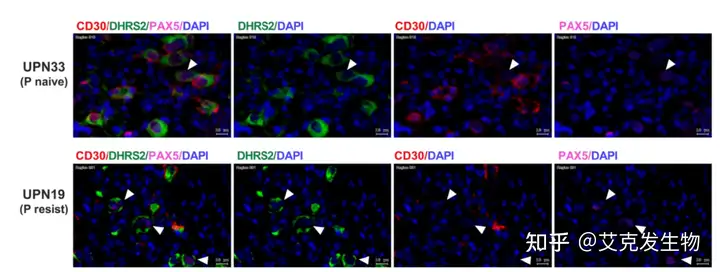
Panel:CD30、DHRS2、PAX5、DAPI

总结
本文揭示了CDP疗法在cHL患者中的作用机制。CDP治疗可恢复抗PD-1耐药的cHL患者的抗肿瘤免疫应答,CDP治疗通过改变IL21+Th细胞的表型和功能,抑制了对CD30+HRS细胞的免疫支持,同时提高了CD30-HRS细胞的免疫原性和细胞毒性反应,进而改善cHL患者的免疫环境和治疗效果。该研究为cHL肿瘤免疫治疗提供了理论基础,同时为抗PD-1耐药患者提供了新的治疗思路。
[1]Nie J, Wang C, Zheng L, Liu Y, Wang C, Chang Y, Hu Y, Guo B, Pan Y, Yang Q, Hu X, Han W. Epigenetic agents plus anti-PD-1 reshapes tumor microenvironment and restores antitumor efficacy in Hodgkin lymphoma. Blood. 2024 Aug 2:blood.2024024487. doi: 10.1182/blood.2024024487. Epub ahead of print. PMID: 39093981.
上一篇:艾克发学术|令狐恩强团队提出ART治疗后PLWH肠道免疫新观点
下一篇:没有了
Copyright© All rights reserved.京ICP备2021017346号